���q���琶�����ۂ�
�������ۂ̍ŏ��P�ʂ͍זE�ł���A���̕����I���̂́A�^���p�N����j�_�Ƃ��������̍����q�A�����Đ��A�C�I���A�����Ȃǂ̒ᕪ�q����Ȃ鍬�����ł���B���̂悤�ȍ������������N�������w�v���Z�X�S�̂��������ۂƂ��Č�������B�������A���̕��q�_�I���J�j�Y���̉𖾂͂��܂��Ȃ���Ă��炸�A����Ȋw�ɂ�����ŏd�v�ۑ�̈�ł���B�{�������ł́A�זE���ŋN���鐶�̕��q�̉��w�v���Z�X�ɒ��ڂ��A���q�V�~�����[�V�����I��@�Ɋ�Â��āA�������ۂ����q���x������{�g���A�b�v���ĕ������w�I�ɗ������邱�Ƃ�ڎw���Ă���B�ŏI�I�ɁA��b�Ȋw�ɂ����ẮA���q�\������g�����Ƃ͉����H�h�̖₢�ɓ����邱�ƂɁA�����āA�Y�Ɖ��p�ɂ����ẮA���q�����Ɋ�Â��āg���莾���ɑ���V�K��܂�f�f�@�h�̊J���ɍv���������ƍl���Ă���B
�w���O���r���T�u���j�b�g�ւ̎_�f���q�N���o�H�̓��v�I���
�@�w���O���r���̓��T�u���j�b�g�ƃ��T�u���j�b�g�ɂ��\������Ă���A�e�T�u���j�b�g�̓w���|�P�b�g�Ɏ_�f���q����荞�ނ��ƂŎ_�f���q�^���@�\�����Ă���B�Ƃ��낪�����\���ł́A�O�̗n�}����w���|�P�b�g�ւƎ_�f���q���ʉ߉\�ȍL���̒ʘH�͑��݂��Ȃ����߁A�����\���ɂ��_�f���q���o���肷��ʘH����肷�邱�Ƃ͍���ł������B�����ŕψّ̃w���O���r���ɂ������╪�q���͊w�v�Z�ɂ���͂��s���Ă������A���ʃq�X�`�W���ߖT�ɑ��݂���q�X�`�W���Q�[�g�ƌĂ��ʘH����v�Ȍo�H�Ƃ�����i�Ⴆ��J. Biol. Chem. 2011, 286, 10515�j�ƁA�T�u���j�b�g�����ɂ��鑽���̋��o�R���镡���̒ʘH����v�Ȍo�H�Ƃ�����i�Ⴆ��J. Am. Chem. Soc. 2012, 134, 11177�j�̂Q������Ă����B
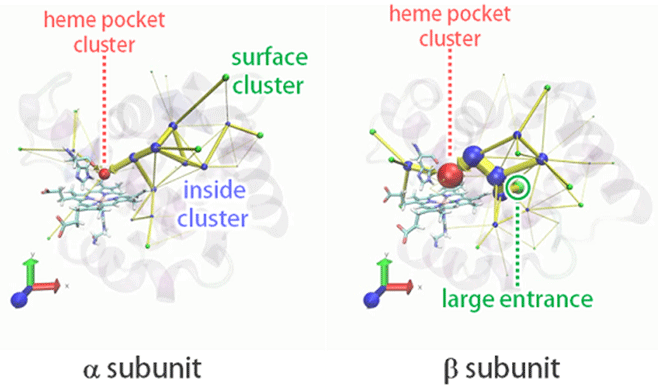
�}�P �w���O���r���̃�����у��T�u���j�b�g�ւ̎_�f���q�i���o�H�̉������ʁB�ΐF�̋��isurface cluster�j�͎_�f���q�̐N������\��
�@�_�f���q�̐N���o�H����肷�邱�Ƃ�ړI�Ƃ��āA�_�f���q�𑽐��n�����������n�t���Ƀw���O���r����z�u�����n�ɂ��āA���q���͊w�iMD�j�V�~�����[�V������128��J��Ԃ����s�����B���ʁA�w���|�P�b�g�ւ̎_�f���q�N���𐔕S��ϑ����邱�Ƃ��ł����B�N���X�^�����O��p���Ď_�f���q�̐N���o�H�v�I�ɉ�͂��邱�ƂŁA�_�f���q�i���o�H�������x�œ��肵���i�}�P�j�B����ꂽ�ʘH�̓��A�����T�u���j�b�g�ɂ����ăT�u���j�b�g�����̑a�������o�R����ʘH�����C���ł���A�q�X�`�W���Q�[�g���o�R�������̂͂킸���ł������B�܂����T�u���j�b�g�ɂ̓��T�u���j�b�g�ɑ��݂��Ȃ��傫�ȓ���������݂��Ă���A�_�f���q�N���̓��T�u���j�b�g�̕����Q�{���x����������������ʂq���x���������������̂ł���B
�y�Q�l�����z
- M. Takayanagi, I. Kurisaki, M. Nagaoka, J. Phys. Chem. B, 117(20), 6082 (2013).
�q�g�w���O���r���̔ʓ��ٓI�A���X�e���b�N����
�@�\�^���p�N���̋@�\�����@�\�̐V�����\���\
�@�^���p�N���A���X�e���[�͐��������ɂƂ��ĕs���ł���B����܂ŁA�Q�̎l���\����ԁiT��Ԃ����R��ԁj�����q�g�w���O���r���iHbA�j�̃A���X�e���b�N����́A�^���p�N���̃A���X�e���b�N�ȍ\������̃p���_�C���ƂȂ��Ă����i�����w�Z�u�����U�v�K�C�����j�B���ɁA����q�ł���_�f���q�iO2�j���u���ʓ��ٓI�ȁv�z���g���s�b�N�G�t�F�N�^�[�Ƃ��ĐU�镑�����ƁA�܂�e�T�u���j�b�g�̃w���S�ɒ����I�Ɍ������邱�ƂŁA�l���\������������N�����Ƃ����l�������A�����ԁA�L��������Ă���B�������Ȃ���A��X�́A�u���ʓ��ٓI�ȁv�A���X�e���b�N���ʂ��K������O2�A���X�e���[�̗B��̃��J�j�Y���ł͂Ȃ����Ƃ��������B
�@���ہA��K�͂ȕ��q�V�~�����[�V�����̉�͌��ʂ���A����O2�����̐��n�t���ł́AO2���A���ڃw���Ɍ������Ȃ��Ă��AT��Ԃ���R��Ԃւ̎l���\���ω��𑣐i���邱�Ƃ����炩�ɂȂ����B�����O2���A����܂Œm���Ă����u���ʓ��ٓI�ȁv�A���X�e���b�N���ʂɉ����āA�u�ʓ��ٓI�ȁv�A���X�e���b�N���ʂ������炷���Ƃ��������Ă���B���́u�ʓ��ٓI�ȁv���ʂ́A�^���p�N�������̂̃T�u���j�b�g�ԐڐG�ɉe����^���A�l���\���ω��ɑ��āA�]�����������Ă���u���ʓ��ٓI�ȁv���ʂƑ���I�Ȗ������ʂ����͂��ł���B����������͂́AHbA�̃A���X�e���b�N������A���q�_�I���_�����I�ɗ������邽�߂̃}�C���X�g�[���ɂȂ�ɈႢ�Ȃ��B
�y�Q�l�����z
- M. Takayanagi, I. Kurisaki, M. Nagaoka, Scientific Reports, 4, 4601 (2014).
�g�����r���̍y�f�������@�\�ɂ�����Na+�̖����̍Č���
�@���̓��Ō��t�Ìň��q�Ƃ��ē����g�����r���́ANa+���ٓI�ȍy�f�������������Ƃ���A���̍y�f������Na+�����ɂ���ăA���X�e���b�N�ɒ��߂����ƍl�����Ă����B�������AX�������\���w�I�����ɂ��ƁANa+���������Ă��g�����r���̍\���͂قƂ�Ǖς��Ȃ��B�X�ɁANa+�̓g�����r���̊�F�����ʋߖT�Ɍ������邽�߁ANa+�Ɗ���̐��ɉדd�����c��i��FArg�j�Ƃ̐Ód�I�˗͑��ݍ�p�ɂ���āA�g�����r���|������̌`�����W������\��������B�����̎�������ANa+�̌����͎��ۂɂ̓g�����r���̍y�f�����ɖ��W�ŁA�ނ���g�����r���|������̌`����j�Q���A�@�\�����𐧌䂷�邱�Ƃ����������B�����ʼn�X�́AMD�V�~�����[�V������p���āA�g�����r���|������̌`���ɂ�����Na+�̌��ʂ������B
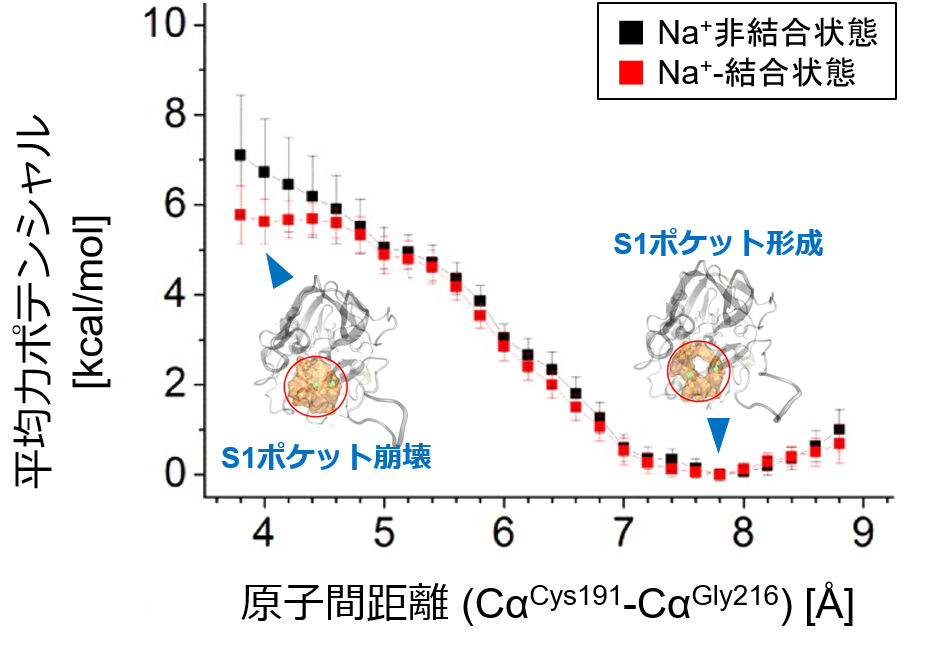
�}�Q S1�|�P�b�g�ό`�̕��ϗ̓|�e���V����
�@�܂��A140 mM NaCl���n�t���ɂ�����S1�|�P�b�g�ό`�̕��ϗ̓|�e���V�������v�Z���AS1�|�P�b�g�̔M�͊w���萫����͂������ʁANa+�̌����͊����^S1�|�P�b�g�`���̈��艻�ɉe�����Ȃ����Ƃ����炩�ɂȂ����i�}�Q�j�B�܂��ANa+�̌����ɂ���āA�g�����r���|������̌`���ɗv����d����3 kcal/mol���������B�܂�A�����̗\�z�ʂ�ANa+�̌����Ƃ������ʓ��ٓI�ȑ��ݍ�p�́A�g�����r���̊����\���̈��艻�ɖ��W�ł���A�܂��A�g�����r���|������̌`���ɕs���ł��邱�Ƃ������ꂽ�B
�@����܂��ANa+�ɂ��g�����r���̍y�f�������@�\���Č��������B140 mM NaCl���n�t���ɂ�����g�����r���|������̌`���ߒ���MD�V�~�����[�V��������ANa+�����́A�g�����r���|������̌`���ɔ���S1�|�P�b�g�̒E���a�ɂ����ďd�v�Ȗ������ʂ����Ă���Ƃ����m��������ꂽ�B���̏�A140 mM XCl�iX��Li+�ANa+�ACs+�̂����ꂩ�j���n�t���ɂ�����g�����r�����͂̃J�`�I�����z����͂������ʁALi+��Cs+�͂��ꂼ��A���̉ߏ�Ȃ��邢�͕s�\���ȕ��z�ɂ���āA�g�����r���|��̑��������̌`����Ód�I�ɑj�Q�������ŁANa+�̓g�����r�����͂ɓK�x�ɕ��z���邱�Ƃɂ���āA���������̃A���T���u���`�����œK�����A��������ő剻���邱�Ƃ��������ꂽ�i�}�R�j�BNa+�ɂ��g�����r���̊������́A�]���l�����Ă������ʓ��ٓI���ݍ�p�ł͂Ȃ��A�g�����r�����͂ւ�Na+�̕��z�Ƃ����ʓ��ٓI���ݍ�p�ɂ���Ē��߂����\�����l������B
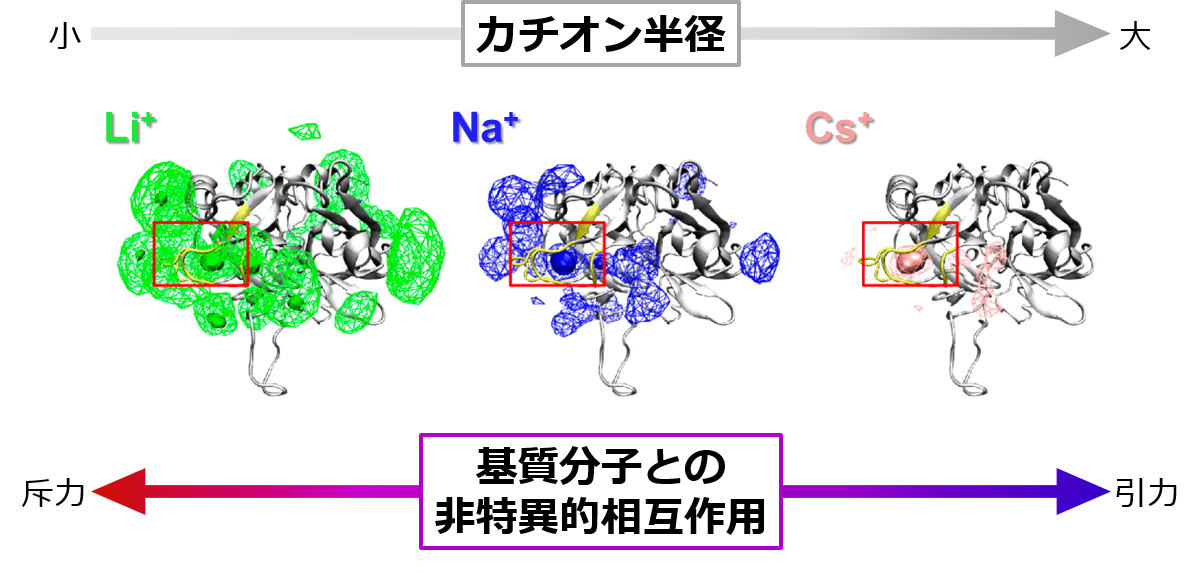
�}�R �g�����r�����͂̃J�`�I�����z
�y�Q�l�����z
- Kurisaki, M.Takayanagi, M.Nagaoka, J. Phys. Chem. B, 119(9), 3635 (2015).
- Kurisaki, C. Barberot, M. Takayanagi, M. Nagaoka, J. Phys. Chem. B, 119(52), 15807 (2015).
- Kurisaki, M. Takayanagi, M. Nagaoka, J. Phys. Chem. B, 120(20), 4540 (2016).
- Kurisaki, M. Nagaoka, J. Phys. Chem. B, 120(46), 11873 (2016).
���n�t���~�I�O���r���̐U���G�l���M�[�ɘa�ߒ��Ɋւ��闝�_�I����
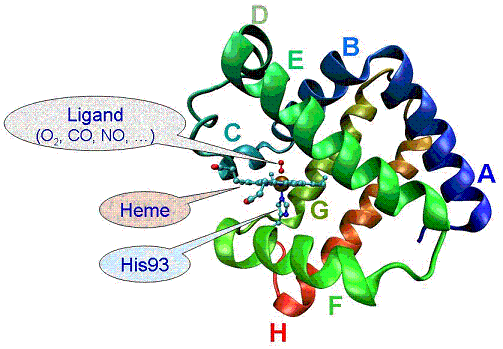
�}�S �~�I�O���r���̗��̍\��
�@�~�I�O���r���i�}�S�j�͌��z���ɂ��w���Ɍ������Ă���O2��CO���̃��K���h���q���𗣂���B���̍ۂ��]��G�l���M�[���M�G�l���M�[�̌`�Ŏ��̗͂n�}�ւƊg�U���Ă����i�}�T�j�B
�@���̌��𗣌��ۂɔ����Đ�����~�I�O���r�������I���̍\���ό`��w���̗]��G�l���M�[�ɘa�ɂ���MD�V�~�����[�V�����ɂ���͂��s���Ă���B���̃��K���h�𗣂̓w���O���r���ɂ�����A���X�e���b�N���ʔ����̃g���K�[�ł���A�^���p�N���̋@�\�ƍ\���_�C�i�~�N�X�̊֘A�𖾂炩�ɂ����ő傫�ȈӋ`������B
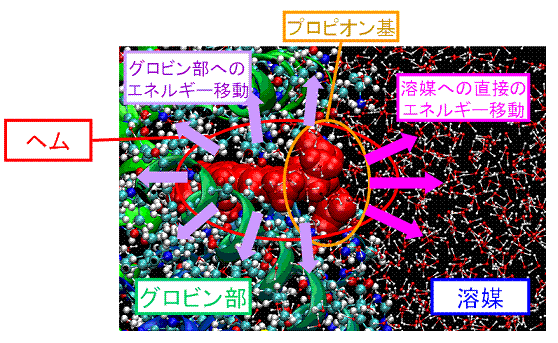
�}�T �w������̗]��G�l���M�[�`�B�̖͎��}
�y�Q�l�����z
- I. Okazaki, Y. Hara, M. Nagaoka, Chem. Phys. Lett., 337, 151 (2001).
- M. Takayanagi, C. Iwahashi, M. Nagaoka, J. Phys. Chem. B, 111(4), 864 (2007).
- M. Takayanagi, H. Okumura, M. Nagaoka, J. Phys. Chem. B, 114(38), 12340 (2010).
���̍����q�̃_�C�i�~�N�X�┽�����ɋy�ڂ��⏞�n���Y�����ʂ̗��_�I�l�@
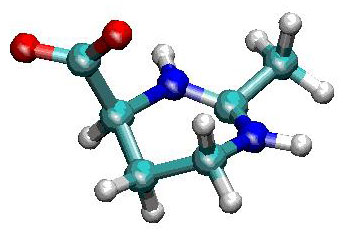
�}�U �G�N�g�C���̕��q�\��
�@�����q�́A�^���p�N���̍\�����萫��A�_�C�i�~�N�X�ɏd�v�Ȋ�^���y�ڂ��Ă���B�זE���̐����q�̐�����ω�������v���͗l�X�����A�ߔN�A�⏞�n���ƌĂ�邠���̃R�\���x���g�i���n�}���q�j���A�^���p�N���̗��̍\�������艻���A���̐����w�I�@�\��ی삵�Ă��鎖�����炩�ɂȂ����B�⏞�n���́A�זE�����Y����ᕪ�q�ł���A���M�⍂���Z�x�Ȃǂ̊��X�g���X�Ɍĉ����čזE���ɒ~�ς����B�⏞�n���͐��̍����q�ɒ��ڍ�p�����ɁA�n�}���q�i��ɐ����q�j�̐�����ω������邱�Ƃɂ���ĊԐړI�Ƀ^���p�N���������艻����B��X�́A�ω����ۂ��זE���ɒ~�ς���⏞�n���̑�\�i�ł����G�N�g�C���i�}�U�j�ɒ��ڂ��A���̐����q�̋����ɗ^����e���������B
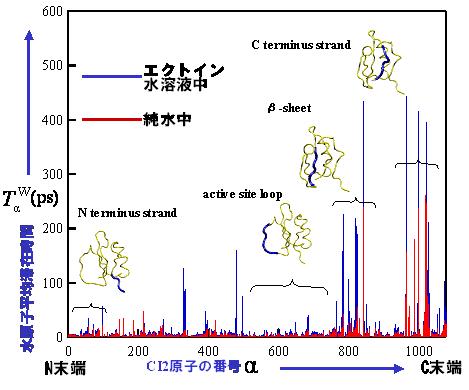
�}�V �G�N�g�C���Y���ɂ��^���p�N���ߖT�̐����q�؍ݎ��Ԃ̑���
�@�L���g���v�V���C���q�r�^�[2(CI2)�����f���^���p�N���Ƃ��čs�����G�N�g�C�����n�t������я�������MD�V�~�����[�V��������A�n�}���q�̔z�ʏ�Ԃ⓮�I�����ɓ����I�ȈႢ�����ꂽ�B�G�N�g�C���́A�^���p�N���ƒ��ڂɂ͋������ݍ�p���Ă��炸�A�G�N�g�C�����n�t���ł̓^���p�N���\�ʕt�߂₻�̍\���̓����������q�̑؍ݎ��Ԃ��傫���������Ă����i�}�V�j�B����̓^���p�N���̗��̍\�������艻���镪�q���x���̏d�v�ȗv���ƍl������B���݂́ACI2�Ƃ͑ΏƓI�ɁA�G���P�t�@�����̂悤�ɏ������A�t���L�V�u���ȃy�v�`�h�z�������̐��n�t���ɂ�����_�C�i�~�N�X�┽�����ɗ^����R�\���x���g�̉e�������Ă���B
�y�Q�l�����z
- I.Yu and M.Nagaoka, Chem. Phys. Lett., 388, 316 (2004).
- I.Yu, M.Takayanagi, M.Nagaoka, J. Phys. Chem. B, 113(11), 3543 (2009).
- I.Yu, T.Tasaki, K.Nakada, M.Nagaoka, J. Phys. Chem. B, 114(38), 12392 (2010).
�~�I�O���r���������̈��萫�̌���
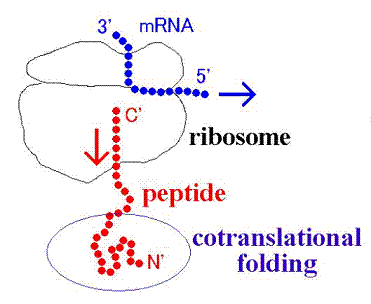
�}�W ���|��I�t�H�[���f�B���O
�@�^���p�N����mRNA�̏���������{�\�[����Ŗ|���B���̍ۂɐL���r��ɂ��镔���������{�\�[������O�ւƘI�o���A�����I�ȁu�t�H�[���f�B���O�v������Ƃ���Ă���i���|��I�t�H�[���f�B���O�A�}�W�j�B�����I�ɂ̓~�I�O���r���Ɏ����^���p�N�������{�\�[���Ɍ��������܂܃w������荞�ނ��Ƃ�������Ă���A�܂��~�I�O�I�r���������̒�����������Β����ق��w���b�N�X�\������葽���Ȃ邱�Ƃ�������Ă���B�������Ȃ��炱�̂悤�Ȓf�ГI�ȏ�������Ă��炸�A���ۂɃ~�I�O���r���̋��|��I�t�H�[���f�B���O���ǂ̂悤�ɐi�s����̂��͏ڂ����͕������Ă��Ȃ��B
�@�����ŕ������~�I�O���r���̋��|��I�t�H�[���f�B���O�̉𖾂ւ̑����Ƃ��āA�w���b�N�X�݂̂��琬�錋���\�����������ɂ����Ăǂ̒��x����ł���̂���MD�V�~�����[�V���������s�����������B���̌��ʁA�Z���������قǃw���b�N�X�\���͕s����ł����̂ɑ��A�����������ł̓w���b�N�X�\��������ł������Ƃ������ꂽ�B
�y�Q�l�����z
- M.Takayanagi, I.Yu, M.Nagaoka, Chem. Phys. Lett., 421(1-3), 300 (2006).
�`���i�^���p�N�j��
�A�~�m�_�������A���i�d���j���Ăł��������q�������ł���A���̓����ɂ����āA����̎O�����\�������B��ӁA���̓����`�B�A���̍\���`���ȂǁA�d�v�Ȑ���������S���Ă���B�A�������A�~�m�_�̌������Ȃ��ꍇ�ɂ̓y�v�`�h�������̓|���y�v�`�h�ƌĂ�邱�Ƃ��������A���̂̎g�����������߂閾�m�ȃA�~�m�_�̌������܂��Ă���킯�ł͂Ȃ��B
�A���X�e���b�N���ݍ�p
�^���p�N���ƃ��K���h���q�̑��ݍ�p���A���K���h�������ʂ����ԓI�ɗ��ꂽ���ʂ̋����ɉe����^���邱�ƁB�^���p�N�������̂ł́A�P�̃T�u���j�b�g�Ɍ����������K���h�����̃T�u���j�b�g�ɉe���������m���Ă���i��F�w���O���r���j�B
�c��
�^���p�N�����\�������{�P�ʂł���A�~�m�_�P�P�̂��ƁB�A�~�m�_�c��ɂ͂Q�O��ނ����݂��A���͂ɐ����q�������Ԃ�����ł���e�����c��Ƌt�Ɏ��͂ɐ����q�����݂��Ȃ��ق�������ȑa�����c��ɕ����邱�Ƃ��ł���B
�~�I�O���r��
��ɋؓ��g�D���ɑ��݂��A�_�f���q�����t������K�v�ƂȂ������_�ŕ��o����`���i�^���p�N�j���B�_�f���q�̓~�I�O���r�����ɖ��ߍ��܂�Ă���S�|���t�B�������q�i�w���j�Ɍ������Ă���B153�̃A�~�m�_���琬��A�W��α�w���b�N�X�\������\������Ă���AX��������܂ɂ�菉�߂ė��̍\�������炩�ɂ��ꂽ���j�I�ȃ^���p�N���ł���B
�⏞�n��
�Ɍ����ɐ������鐶�����A���X�g���X���琶����������邽�߂ɍזE���ɒ~�ς���ᕪ�q�������̑��́B��\�I�Ȃ��̂ɁA�g���n���[�X�A�X�N���[�X���̓����q��A�v�������A�O���V���Ȃǂ̃A�~�m�_�i���m�}�[�j������B�⏞�n���́A���̍����q�ɁA���ڍ�p���邱�ƂȂ��A�^���p�N���Ȃǂ̗��̍\�������艻���邱�Ƃ��A�����I�ɒm���Ă���B
�G�N�g�C��
�G�N�g�C���iectoine �i2-methyl-4-carboxyl-1,4,5,6-tetrahydropyrimidine�j�j�͉����≖�����܂����Ȃǂ̉ߍ��Ȋ��ɐ�������������Ȃǂ����A��\�I�ȕ⏞�n���ł���B���n�t���ł́A�o���C�I����ԁi�P�ꕪ�q���Ńv���X�ƃ}�C�i�X�̓d�ׂ����������C�I����ԁj�ƂȂ�A�����q�����������t����B���q���͊w�iMD�j�V�~�����[�V������p�������O���[�v�̌����ɂ���āA�^���p�N���\�ʂ̐����q�̊g�U���A�G�N�g�C���Y���ɂ���đ啝�ɒx���Ȃ鎖�����炩�ɂȂ����B
�L���g���v�V���C���q�r�^�[2�iCI2�j
���܂��܂ȓ��A���Ɋ܂܂��y�f�̈��ŁA�C���X�����̕���𑣂���p������Bα�փ��b�N�X�\����β�V�[�g�\�����܂ށA���^�̋���^���p�N���B�K�x�ȑ傫���ƁA����ȗ��̍\���������߂ɁA���q���͊w�iMD�j�V�~�����[�V�����ɂ����郂�f���^���p�N���Ƃ��āA�p�ɂɗp������B
�G���P�t�@����
5�̃A�~�m�_����Ȃ鏬�y�v�`�h�i�A�~�m�_�z��FTYR-GLY-GLY-PHE-MET�i������TYR�F�`���V���AGLY�F�O���V���APHE�F�t�F�j���A���j���AMET�F���`�I�j���ł���B�j�j�B�_�o�זE����̎�e�̃^���p�N���i�I�s�I�C�h���Z�v�^�[�j�Ɍ������A�����q�l���l�̒��ɍ�p��悷��B���n�t���ŁA�l�X�ȗ��̍\�����Ƃ邽�߂ɁA���q���͊w�iMD�j�V�~�����[�V������p�������q���̍\����͂̃��f���n���Ƃ��ĕp�ɂɗp������B
�U����N
���q�̐U����Ԃ��A�U������范�����G�l���M�[����荂����ԁi�U����N��ԁj�ւƕω����邱�ƁB���E�M�G�l���M�[����^���邱�Ƃň����N�������Ƃ��ł��A���̌�̊ɘa�ߒ��ɂ��ėl�X�Ȏ����I�E���_�I��@�ɂ�茤������Ă���B
���{�\�[��
���b�Z���W���[RNA�imRNA�j�̏���ǂݎ��^���p�N�����������闱�q�q�őS�Ă̍זE���ɑ��݂���B�^�j�����ɂ����Ă�40�X�x�h�x���O�iS�j��60S�̂Q�̃T�u���j�b�g����\������Ă���A�e�T�u���j�b�g�����{��RNA���q�Ɛ��\��ނ̃^���p�N������Ȃ���ɋ���ȕ��q�iRNA-�^���p�N�������́j�ł���B�ߔN�w��������͂ɂ�藧�̍\���������������߁A���q���x������^���p�N�������@�\���𖾂��悤�Ɛ��E���Ō��������������Ă���B
�t�H�[���f�B���O
��X�̃A�~�m�_����������ɘA���i�d���j���Ăł��������q�������ł���^���p�N�����A����̗��̍\���i�R���\���j���Ƃ邱�Ƃ��t�H�[���f�B���O�Ƃ����A�^���p�N���̋@�\�����ɋɂ߂ďd�v�Ȗ������ʂ����Ă���B�ǂ̂悤�ɂ��ē���̍\���ւ̃t�H�[���f�B���O�������Ă��邩�͋ɂ߂ďd�v�Ȍ����e�[�}�ƂȂ��Ă���A�����Ȍ������������Ă���B
α�w���b�N�X
�A�~�m�_�c��^���p�N�����ʼnE�����̗����i�点��j�\�����Ƃ��Ă���ӏ���α�w���b�N�X�Ƃ����Bα�w���b�N�X�́An �Ԗڂ̃A�~�m�_�c��̃J���{�j���_�f���qO�� n+4 �Ԗڂ̎c��̃A�~�h�� NH �����f�������`�����Ă��邽�߈��艻���Ă���B���̗�����3.6�c���1��]���A�����͊O���Ɍ������Ĕ�яo���Ă���B
β�V�[�g
�^���p�N�����\�����镡���̃A�~�m�_�ɂ���Č`�����������I�ȗ��̍\���̂ЂƂB���s�ɗׂ荇�����y�v�`�h���̊ԂŁA����̍��� N-H�i�A�~�h��j�̕������A�אڂ��鍽��C=O �i�J���{�j����j�̕����Ɛ��f�������`�����A�S�̂Ƃ��ĕ��ʍ\�����`�����Ă���B�����̐��f�����ɂ���č\�����ێ�����邽�߁A���Ɉ��肵�Ă���B
����
�A�~�m�_�c��i-NH-CH�i-R�j-CO-�j�̂����c��ɈقȂ��Ă���i-R�j�̕��ʁB���������f���q�P�����ł���ł��P���ȃO���V���A�T���ƂU�����k�������傫�ȃw�e���\�������g���v�g�t�@���A�v���g������o���₷���J���{�L�V����iCOOH�j�����A�X�p���M���_�Ȃǂ�����A�����̈Ⴂ���c��̑��l�Ȑ��������肵�Ă���B