| [Site Map][Japanese][English] |
-
Student Recruitment
-
Project
- Computational Science
- Nonequilibrium Systems
- Chemical Reactions
- Macroscopic Chemical Phenomena
- Life Phenomena
- Multiscale Information Processing
- Industry Applications
- Meetings
- FY 2022
- FY 2021
- FY 2020
- FY 2019
- FY 2018
- FY 2017
- FY 2016
- FY 2015
- FY 2014
- FY 2013
- FY 2012
- FY 2011
- FY 2010
- FY 2009
- FY 2008
- FY 2007
- FY 2006
- FY 2005
- FY 2004
- FY 2003
- FY 2000
- FY 2019
- FY 2018
- FY 2017
- FY 2016
- FY 2015
- FY 2014
- FY 2013
- FY 2012
- FY 2011
- FY 2010
- FY 2009
- FY 2008
- FY 2007
- FY 2004-2006
- FY 2003
ConceptResearchesMeetings & Seminars
Open Seminars
References
Facilities
-
People
- Staff
- PostDocs & Students
- OB & OG
- OB & OG Messages
- FY 2018-
- FY 2015-2017
- FY 1999-2014
MembersSnapshots -
Access
-
Link
From Molecules to Life Phenomena
Cell is a minimum unit of life phenomena, and its physical entity is a mixture of biopolymers (e.g., protein, DNA and RNA) and low-weight molecules (e.g., water, ion, lipid etc). Such a mixture of molecules generate a series of chemical reactions which can be seen as life phenomena. However, the mechanism is still elusive at the molecular level, and thus its understanding remains to be one of the central issues of the modern science. In our laboratory, we are addressing full understanding of life phenomena from the physicochemical aspect employing "bottom-up" approach, where chemical processes in the cell, attributed to biomolecules, are examined by molecular simulations. Our goal is to give an answer "what is life?" as basic field of science, and also to contribute to develop de-novo drugs for specific disease and de-novo diagnostic methods based on molecular properties as applied filed of science and engineering.
Statistical analysis of multiple oxygen entry pathways in hemoglobin subunits
Human hemoglobin (HbA) is an oxygen transport protein composed of two α and two β subunits. Each HbA subunit stores an oxygen molecule (O2) in a cavity called "heme pocket" to transport O2. However, in the crystal structures, there is no static channel from solvent to the heme pocket. Thus there is an ongoing debate over the O2 entry and escape pathways. Experimental studies with mutated HbA revealed that O2 directly escapes from the heme pocket to solvent through the channel called "histidine gate" (His-gate) which is located near the distal histidine (J. Biol. Chem. 2011, 286, 10515). Meanwhile, computational studies with molecular dynamics (MD) simulations revealed that O2 escapes from the heme pocket through multiple pathways ( J. Am. Chem. Soc. 2012, 134, 11177).
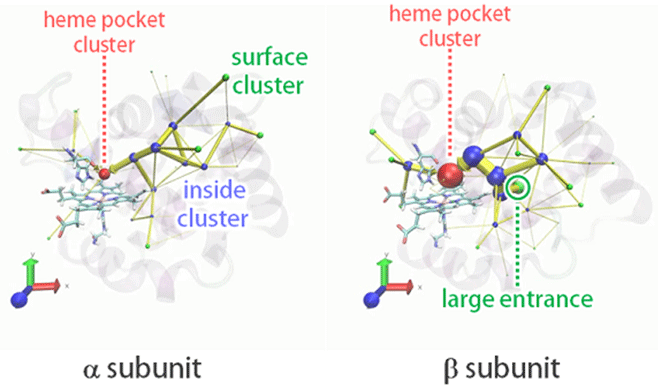
Figure1. Visualized O2 entry pathways from solvent to the heme pocket in the HbA α and two β subunits. Green spheres represent portals into the cavities.
In order to determine O2 entry pathway, we executed 128 independent MD simulations in O2-rich aqueous solvent with Hemoglobin. As a result, we obtained hundreds of O2 entry events in the α and two β subunits. We visualized the entry pathway distributions using the newly developed IPIC (intrinsic pathway identification by clustering) method with the help of clustering (Fig.1). In both subunits, O2 entry mainly occurs through multiple pathways and rarely through the His-gate. In addition, there are big entry pathways in α subunit which do not exist in β subunit. This result at the molecular level is in accordance with the experimental finding that O2 entry occurs twice as fast in β subunit.
[Reference] M. Takayanagi, I. Kurisaki, M. Nagaoka, J. Phys. Chem. B, 117, 6082 (2013).
Non-site-specific allosteric effect of O2 on human hemoglobin
Protein allostery is essential for vital activities. Allosteric regulation of human hemoglobin (HbA) with two quaternary states T and R has been a paradigm of allosteric structural regulation of proteins (learn in Biology Ⅱ in high school). It is widely accepted for a long time that O2 act as a "site-specific" homotropic effector, or the successive O2 binding to the heme brings about the quaternary regulation. However, we succeeded to demonstrate that the effect of "site-specific" allostery is not the only mechanism for O2 allostery.
In fact, our ensemble MD simulations of T-state HbA in O2-rich aqueous solution revealed that the solution environment of high O2 partial pressure enhances the quaternary change from T to R without binding to the heme, suggesting an additional "non-site-specific" allosteric effect of O2. The non-site-specific effect should play a complementary role in the quaternary change by affecting the intersubunit contacts, i.e., hydrogen bonds and salt bridges. This kind of analyses must become a milestone in comprehensive understanding of the allosteric regulation of HbA from the molecular point of view.
[Reference] M. Takayanagi, I. Kurisaki, M. Nagaoka, Scientific Reports, 4, 4601 (2014).
Theoretical study on relaxation process of myoglobin in aqueous solvent
Myoglobin contains heme groups, which binds a ligand molecule (i.e. O2, CO, NO …) with the iron atom. Visible light absorption produces photodissociation of CO bound myoglobin (MbCO), whose excessive energy is released into solvent as heat flow.
By utilizing MD simulations, we analyzed isotropic deformation of myoglobin 3D structure and relaxation processes of excessive energy release. Since the ligand dissociation triggers expression of allosteric effect of myglobin, understating the mechanism is important to clarify the relationship between the protein structure and function.
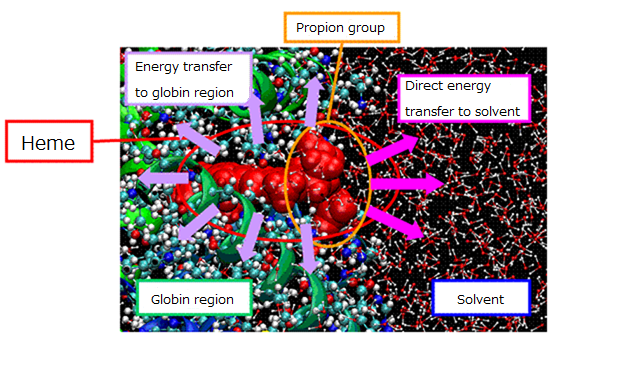
Figure 2. Schematic view of relaxation pathway for excessive energy flow from the heme.
[Reference]
I. Okazaki, Y. Hara, M. Nagaoka, Chem. Phys. Lett., 337, 151 (2001).
M. Takayanagi, C. Iwahashi, M. Nagaoka, J. Phys. Chem. B, 111, 864 (2007).
M. Takayanagi, H. Okumura, M. Nagaoka, J. Phys. Chem. B, 114, 12340 (2010).
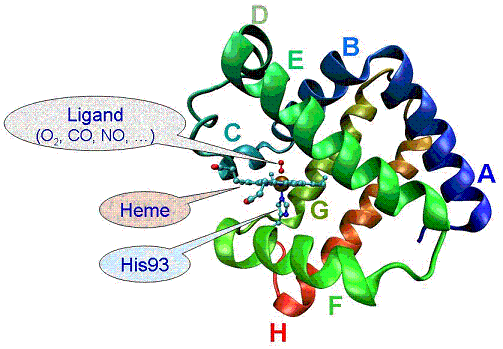
Figure 3. 3D structure of myoglobin.
Theoretical study on the effect of compatible solutes on dynamics and reactivity of biomacromolecules
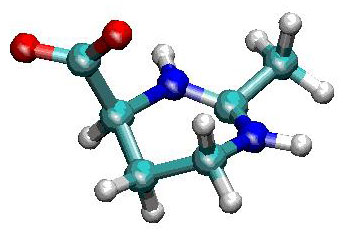
Figure 4. Molecular structure of ectoine.
Water molecules play important roles in the stability and the dynamics of protein conformation. Although there are a number of factors to alter the property of water molecules in a cellular environment, it has been recently elucidated that compatible solutes make the protein conformation stabilized and maintain the biological activity. Compatible solutes are such compounds with low molecular weights that are produced by the cells of organisms and are accumulated in them in response to such high environmental stresses as the high salt concentration or the high temperature. Although they do not interact directly with macromolecules themselves, they play an indirect role to modify the stability of proteins by altering the solvent properties. We have focused on an ectoine molecule, which is the most common compatible solutes found in the cytosol of aerobic heterotrophic bacteria, and examined the effect of the compatible solutes on the dynamic property of water molecules.
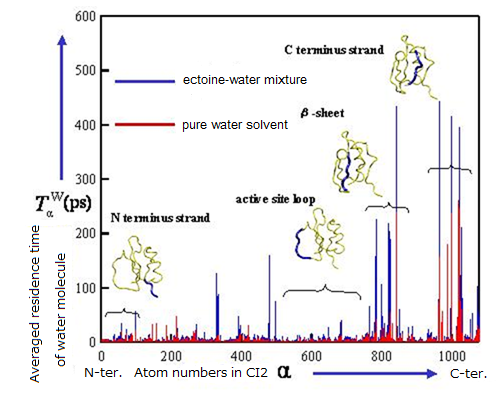
Figure 5. Increase of residence time of water molecules in the vicinity of protein surface under the presence ectoine molecules.
As a model, we executed MD simulations of chymotrypsin inhibitor 2 (CI2) in ectoine-water mixture and pure water solvent. From the results obtained, some characteristic differences in coordination of water molecules and their dynamic behavior around the protein were found. Although ectoin molecules do not interact directly with macromolecules themselves, they significantly slow down the diffusion of water molecules near the protein surface in addition to that in the bulk solution. This should play an important role on the stabilization of protein conformation at the molecular level. We are now addressing the elucidation of the effect of cosolvents on the dynamics and reactivity in aqueous solution using relatively small and flexible peptide hormone such as enkephalin compared with CI2.
[references] I.Yu and M.Nagaoka, Chem. Phys. Lett., 388, 316 (2004).
I.Yu, M.Takayanagi, M.Nagaoka, J. Phys. Chem. B, 113, 3543 (2009).
I.Yu, T.Tasaki, K.Nakada, M.Nagaoka, J. Phys. Chem. B, 114, 12392 (2010).
Study of the stability of partial chains from apo-myoglobin
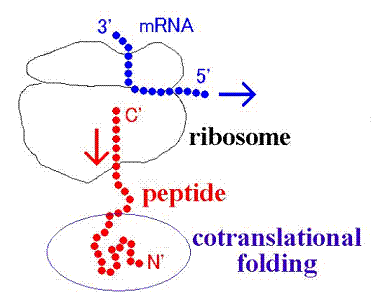
Figure 6. Schematic view of cotranslational folding
mRNA is translated into the corresponding protein upon ribosome. In the step of the extension of polypeptide chain, a part of the chain is located out of ribosome and partially folds (cotranslational folding). The earlier experimental studies indicated that HbA α subunit captures heme group while binding to ribosome. It was also revealed that the contents of helix formation increase with the elongation of partial chain of myoglobin. However, the information we can access about such phenomena is still insufficient and it remains elusive how cotranslational folding of myoglobin proceeds.
As a first step to elucidate the mechanism of cotranslational folding of partial myoglobin chain, we performed MD simulations for the helix domain obtained from X-ray crystallography structure, and assessed the stability. Then the analyses indicated that short partial chain cannot form alpha helix stably, but long partial chain can.
[references] M.Takayanagi, I.Yu, M.Nagaoka, Chem. Phys. Lett., 421, 300 (2006).
protein
アミノ酸が多数連結(重合)してできた高分子化合物であり、生体内環境において、特定の三次元構造を持つ。代謝、生体内情報伝達、生体構造形成など、重要な生命活動を担っている。連結したアミノ酸の個数が少ない場合にはペプチドもしくはポリペプチドと呼ばれることが多いが、名称の使い分けを決める明確なアミノ酸の個数が決まっているわけではない。
compatible solute
極限環境に生息する生物が、環境ストレスから生命活動を守るために細胞内に蓄積する低分子化合物の総称。代表的なものに、トレハロース、スクロース等の糖分子や、プロリン、グリシンなどのアミノ酸(モノマー)がある。補償溶質は、生体高分子に、直接作用することなく、タンパク質などの立体構造を安定化することが、実験的に知られている。
ectoine
エクトイン(ectoine (2-methyl-4-carboxyl-1,4,5,6-tetrahydropyrimidine))は塩水湖や塩分を含んだ砂漠などの過酷な環境に生息する微生物などがもつ、代表的な補償溶質である。水溶液中では、双性イオン状態(単一分子内でプラスとマイナスの電荷が分離したイオン状態)となり、水分子を強く引き付ける。分子動力学シミュレーションを用いた当グループの研究によって、タンパク質表面の水分子の拡散が、エクトイン添加によって大幅に遅くなる事が明らかになった。
chymotrypsin inhibitor 2(CI2)
さまざまな動植物に含まれる酵素の一種で、インスリンの分泌を促す作用がある。αへリックス構造とβシート構造を含む、小型の球状タンパク質。適度な大きさと、安定な立体構造を持つために、分子動力学シミュレーションにおけるモデルタンパク質として、頻繁に用いられる。
enkephalin
5つのアミノ酸からなる小ペプチド(アミノ酸配列:TYR-GLY-GLY-PHE-MET(ここでTYR:チロシン、GLY:グリシン、PHE:フェニルアラニン、MET:メチオニンである。))。神経細胞膜上の受容体タンパク質(オピオイドレセプター)に結合し、モルヒネ同様の鎮痛作用を呈する。水溶液中で、様々な立体構造をとるために、分子動力学シミュレーションを用いた分子立体構造解析のモデル溶質として頻繁に用いられる。
vibrational excitation
分子の振動状態が、振動がより激しくエネルギーがより高い状態(振動励起状態)へと変化すること。光・熱エネルギー等を与えることで引き起こすことができ、その後の緩和過程について様々な実験的・理論的手法により研究されている。
ribosome
メッセンジャーRNA(mRNA)の情報を読み取りタンパク質を合成する粒子状分子で全ての細胞内に存在する。真核生物においては40スベドベルグ(S)と60Sの2つのサブユニットから構成されており、各サブユニットも数本のRNA分子と数十種類のタンパク質からなる非常に巨大な分子(RNA-タンパク質複合体)である。近年X線結晶解析により立体構造が判明したため、原子レベルからタンパク質合成機構を解明しようと世界中で研究が活発化している。
folding
種々のアミノ酸が多数鎖状に連結(重合)してできた高分子化合物であるタンパク質が、特定の立体構造(3次構造)をとることをフォールディングといい、タンパク質の機能発現に極めて重要な役割を果たしている。どのようにして特定の構造へのフォールディングが生じているかは極めて重要な研究テーマとなっており、活発な研究が続けられている。
myoglobin
主に筋肉組織中に存在し、酸素分子を血液から受け取り必要となった時点で放出する蛋白(タンパク)質。酸素分子はミオグロビン中に埋め込まれている鉄ポルフィリン分子(ヘム)に結合している。153個のアミノ酸から成り、8個のαヘリックス構造から構成されており、X線結晶回折により初めて立体構造が明らかにされた歴史的なタンパク質である。
αhelix
アミノ酸残基がタンパク質中で右巻きの螺旋(らせん)構造をとっている箇所をαヘリックスという。αヘリックスは、n 番目のアミノ酸残基のカルボニル酸素原子Oと n+4 番目の残基のアミド基 NH が水素結合を形成しているため安定化している。この螺旋は3.6残基で1回転し、側鎖は外側に向かって飛び出している。
βsheet
タンパク質を構成する複数のアミノ酸によって形成される特徴的な立体構造のひとつ。並行に隣り合ったペプチド鎖の間で、一方の鎖の N-H(アミド基)の部分が、隣接する鎖のC=O (カルボニル基)の部分と水素結合を形成し、全体として平面構造を形成している。多数の水素結合によって構造が保持されるため、非常に安定している。
residue
タンパク質を構成する基本単位であるアミノ酸1つ1つのこと。アミノ酸残基には20種類が存在し、周囲に水分子がいる状態が安定である親水性残基と逆に周囲に水分子が存在しないほうが安定な疎水性残基に分けることができる。
side chain
アミノ酸残基(-NH-CH(-R)-CO-)のうち残基毎に異なっている(-R)の部位。側鎖が水素原子1個だけである最も単純なグリシン、5員環と6員環が縮合した大きなヘテロ環構造を持つトリプトファン、プロトンを放出しやすいカルボキシル基(COOH)を持つアスパラギン酸などがあり、側鎖の違いが残基の多様な性質を決定している。